饱和蒸汽压与温度计算关系
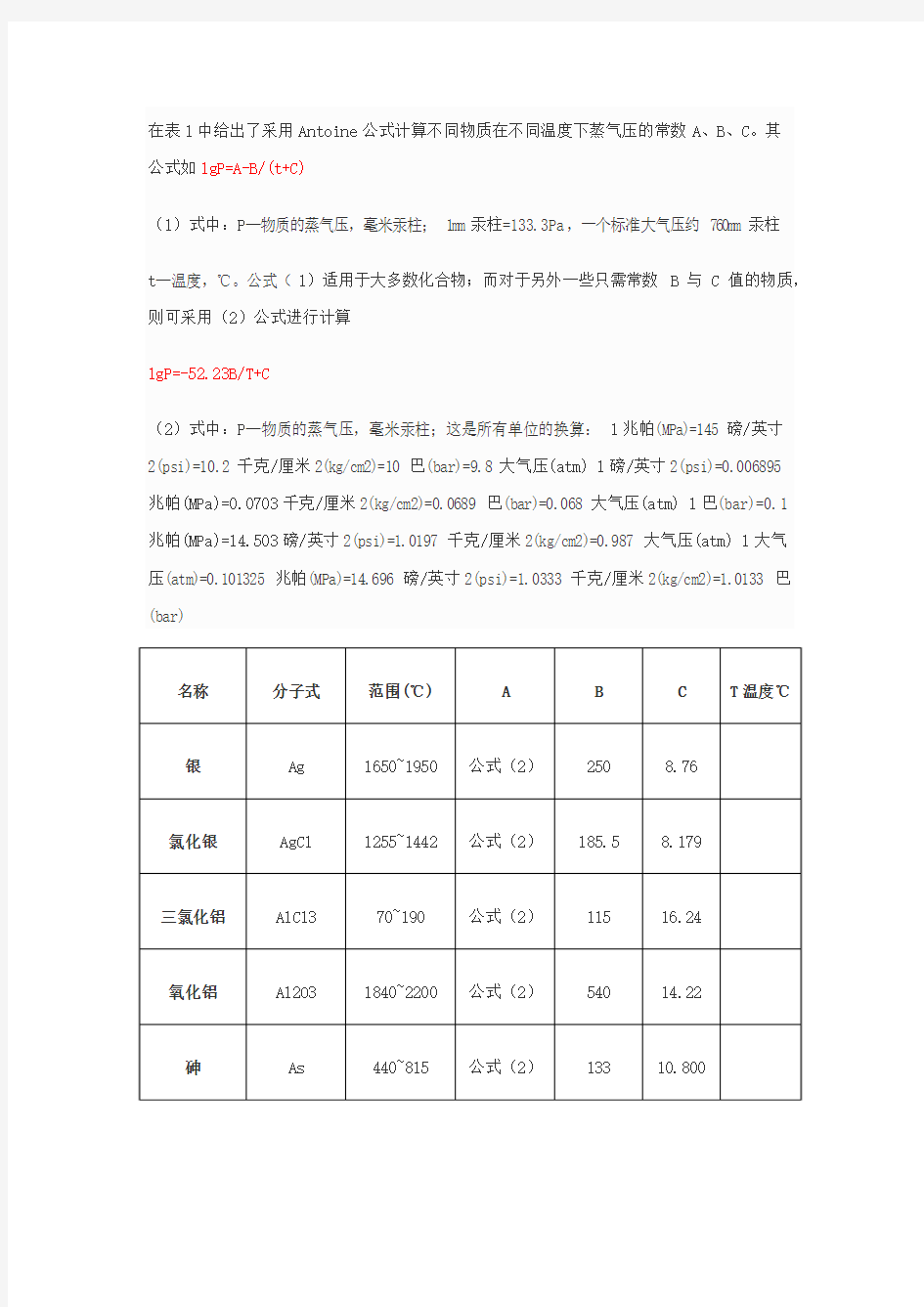

在表1中给出了采用Antoine公式计算不同物质在不同温度下蒸气压的常数A、B、C。其
公式如lgP=A-B/(t+C)
(1)式中:P—物质的蒸气压,毫米汞柱;1mm汞柱=133.3Pa,一个标准大气压约760mm汞柱t—温度,℃。公式(1)适用于大多数化合物;而对于另外一些只需常数B与C值的物质,则可采用(2)公式进行计算
lgP=-52.23B/T+C
(2)式中:P—物质的蒸气压,毫米汞柱;这是所有单位的换算:1兆帕(MPa)=145磅/英寸
2(psi)=10.2千克/厘米2(kg/cm2)=10巴(bar)=9.8大气压(atm) 1磅/英寸2(psi)=0.006895
兆帕(MPa)=0.0703千克/厘米2(kg/cm2)=0.0689巴(bar)=0.068大气压(atm) 1巴(bar)=0.1
兆帕(MPa)=14.503磅/英寸2(psi)=1.0197千克/厘米2(kg/cm2)=0.987大气压(atm) 1大气
压(atm)=0.101325兆帕(MPa)=14.696磅/英寸2(psi)=1.0333千克/厘米2(kg/cm2)=1.0133巴(bar)
饱和蒸气压计算方法
饱和蒸气压 编辑[bǎo hézhēng qìyā] 在密闭条件中,在一定温度下,与固体或液体处于相平衡的蒸气所具有的压力称为饱和蒸气 压。同一物质在不同温度下有不同的蒸气压,并随着温度的升高而增大。不同液体饱和蒸气 压不同,溶剂的饱和蒸气压大于溶液的饱和蒸气压;对于同一物质,固态的饱和蒸气压小于 液态的饱和蒸气压。 目录 1定义 2计算公式 3附录 ?计算参数 ?水在不同温度下的饱和蒸气压 1定义编辑 饱和蒸气压(saturated vapor pressure) 例如,在30℃时,水的饱和蒸气压为4132.982Pa,乙醇为10532.438Pa。而在100℃时,水的 饱和蒸气压增大到101324.72Pa,乙醇为222647.74Pa。饱和蒸气压是液体的一项重要物理性 质,液体的沸点、液体混合物的相对挥发度等都与之有关。 2计算公式编辑 (1)Clausius-Claperon方程:d lnp/d(1/T)=-H(v)/(R*Z(v)) 式中p为蒸气压;H(v)为蒸发潜热;Z(v)为饱和蒸汽压缩因子与饱和液体压缩因子之差。 该方程是一个十分重要的方程,大部分蒸汽压方程是从此式积分得出的。 (2)Clapeyron 方程: 若上式中H(v)/(R*Z(v))为与温度无关的常数,积分式,并令积分常数为A,则得Clapeyron方 程:ln p=A-B/T 式中B=H(v)/(R*Z(v))。 (3)Antoine方程:lg p=A-B/(T+C) 式中,A,B,C为Antoine常数,可查数据表。Antoine方程是对Clausius-Clapeyron方程最 简单的改进,在1.333~199.98kPa范围内误差小。 3附录编辑 计算参数 在表1中给出了采用Antoine公式计算不同物质在不同温度下蒸气压的常数A、B、C。其公 式如下 lgP=A-B/(t+C)(1) 式中:P—物质的蒸气压,毫米汞柱; t—温度,℃ 公式(1)适用于大多数化合物;而对于另外一些只需常数B与C值的物质,则可采用(2) 公式进行计算 lgP=-52.23B/T+C (2) 式中:P—物质的蒸气压,毫米汞柱; 表1 不同物质的蒸气压 名称分子式范围(℃) A B C 1,1,2-三氯乙烷C2H3Cl3 \ 6.85189 1262.570 205.170 1,1,2一三氯乙烯C2HCl3 \ 7.02808 1315.040 230.000 1,2一丁二烯C4H6 -60~+80 7.16190 1121.000 251.000
水在不同温度下的饱和蒸气压
水在不同温度下的饱和 蒸气压 Document number:WTWYT-WYWY-BTGTT-YTTYU-2018GT
饱和蒸(saturatedvaporpressure) 在密闭条件中,在一定下,与或处于相的蒸气所具有的称为饱和蒸气压。同一在不同温度下有不同的蒸气压,并随着温度的升高而增大。不同液体饱和蒸汽压不同,溶剂的饱和蒸汽压大于溶液的饱和蒸汽压;对于同一物质,固态的饱和蒸汽压小于液态的饱和蒸汽压。例如,在30℃时,水的饱和蒸气压为,为。而在100℃时,水的饱和蒸气压增大到,乙醇为。饱和蒸气压是液体的一项重要,如液体的、液体的相对挥发度等都与之有关。 饱和蒸气压 水在不同温度下的饱和蒸气压 SaturatedWaterVaporPressuresatDifferentTemperatures
饱和蒸汽压公式 (1)Clausius-Claperon方程:dlnp/d(1/T)=-H(v)/(R*Z(v)) 式中p为蒸汽压;H(v)为蒸发潜热;Z(v)为饱和蒸汽压缩因子与饱和液体压缩因子之差。 该方程是一个十分重要的方程,大部分蒸汽压方程是从此式积分得出的。 (2)Clapeyron方程: 若上式中H(v)/(R*Z(v))为与温度无关的常数,积分式,并令积分常数为A,则得Clapeyron方程:lnp=A-B/T 式中B=H(v)/(R*Z(v))。 (3)Antoine方程:lnp=A-B/(T+C) 式中,A,B,C为Antoine常数,可查数据表。Antoine方程是对Clausius-Clapeyron方程最简单的改进,在~范围内误差小。 附录 在表1中给出了采用Antoine公式计算不同物质在不同温度下蒸气压的常数A、B、C。其公式如下 lgP=A-B/(t+C)(1) 式中:P—物质的蒸气压,毫米汞柱; t—温度,℃ 公式(1)适用于大多数化合物;而对于另外一些只需常数B与C值的物质,则可采用(2)公式进行计算 lgP=T+C(2) 式中:P—物质的蒸气压,毫米汞柱; 表1不同物质的蒸气压 名称分子式范围(℃)ABC 银Ag1650~1950公式(2) 氯化银AgCl1255~1442公式(2)三氯化铝AlCl370~190公式(2)氧化铝Al2O31840~2200公式(2)
水的饱和蒸汽压与温度对应表
水的饱和蒸汽压与温度对应表 一、水的饱和蒸汽压与温度的关系 蒸汽压是一定外界条件下,液体中的液态分子会蒸发为气态分子,同时气态分子也会撞击液面回归液态。这是单组分系统发生的两相变化,一定时间后,即可达到平衡。平衡时,气态分子含量达到最大值,这些气态分子对液体产生的压强称为蒸气压。 水的表面就有水蒸气压,当水的蒸气压达到水面上的气体总压的时候,水就沸腾。我们通常看到水烧开,就是在100摄氏度时水的蒸气压等于一个大气压。蒸气压随温度变化而变化,温度越高,蒸气压越大,当然还和液体种类有关。 一定的温度下,与同种物质的液态(或固态)处于平衡状态的蒸气所产生的压强叫饱和蒸气压,它随温度升高而增加。如:放在杯子里的水,会因不断蒸发变得愈来愈少。如果把纯水放在一个密闭的容器里,并抽走上方的空气。当水不断蒸发时,水面上方气相的压力,即水的蒸气所具有的压力就不断增加。但是,当温度一定时,气相压力最终将稳定在一个固定的数值上,这时的气相压力称为水在该温度下的饱和蒸气压力。当气相压力的数值达到饱和蒸气压力的数值时,液相的水分子仍然不断地气化,气相的水分子也不断地冷凝成液体,只是由于水的气化速度等于水蒸气的冷凝速
度,液体量才没有减少,气体量也没有增加,液体和气体达到平衡状态。所以,液态纯物质蒸气所具有的压力为其饱和蒸气压力时,气液两相即达到了相平衡。饱和蒸气压是物质的一个重要性质,它的大小取决于物质的本性和温度。饱和蒸气压越大,表示该物质越容易挥发。 二、水的饱和蒸汽压与温度对应表 水的饱和蒸汽压与温度对应表
三、水的饱和蒸汽压与温度的换算公式 当10℃≤T≤168℃时,采用安托尼方程计算:lgP=7.07406-(1657.46/(T+227.02)) 式中:P——水在T温度时的饱和蒸汽压,kPa; T——水的温度,℃ 四、水的饱和蒸汽压曲线
水在不同温度下的饱和蒸气压
饱和蒸气压(s a t u r a t e d v a p o r p r e s s u r e) 在密闭条件中,在一定温度下,与液体或固体处于相平衡的蒸气所具有的压力称为饱和蒸气压。同一物质在不同温度下有不同的蒸气压,并随着温度的升高而增大。不同液体饱和蒸汽压不同,溶剂的饱和蒸汽压大于溶液的饱和蒸汽压;对于同一物质,固态的饱和蒸汽压小于液态的饱和蒸汽压。例如,在30℃时,水的饱和蒸气压为4132.982Pa,乙醇为10532.438Pa。而在100℃时,水的饱和蒸气压增大到101324.72Pa,乙醇为222647.74Pa。饱和蒸气压是液体的一项重要物理性质,如液体的沸点、液体混合物的相对挥发度等都与之有关。 饱和蒸气压曲线 水在不同温度下的饱和蒸气压 SaturatedWaterVaporPressuresatDifferentTemperatures
编辑本段饱和蒸汽压公式 (1)Clausius-Claperon方程:dlnp/d(1/T)=-H(v)/(R*Z(v)) 式中p为蒸汽压;H(v)为蒸发潜热;Z(v)为饱和蒸汽压缩因子与饱和液体压缩因子之差。 该方程是一个十分重要的方程,大部分蒸汽压方程是从此式积分得出的。 (2)Clapeyron方程: 若上式中H(v)/(R*Z(v))为与温度无关的常数,积分式,并令积分常数为A,则得Clapeyron 方程:lnp=A-B/T 式中B=H(v)/(R*Z(v))。 (3)Antoine方程:lnp=A-B/(T+C)
式中,A,B,C为Antoine常数,可查数据表。Antoine方程是对Clausius-Clapeyron方程最简单的改进,在1.333~199.98kPa范围内误差小。 编辑本段附录 在表1中给出了采用Antoine公式计算不同物质在不同温度下蒸气压的常数A、B、C。其公式如下 lgP=A-B/(t+C)(1) 式中:P—物质的蒸气压,毫米汞柱; t—温度,℃ 公式(1)适用于大多数化合物;而对于另外一些只需常数B与C值的物质,则可采用(2)公式进行计算 lgP=-52.23B/T+C(2) 式中:P—物质的蒸气压,毫米汞柱; 表1不同物质的蒸气压 名称分子式范围(℃)ABC 银Ag1650~1950公式(2)2508.76 氯化银AgCl1255~1442公式(2)185.58.179 三氯化铝AlCl370~190公式(2)11516.24 氧化铝Al2O31840~2200公式(2)54014.22 砷As440~815公式(2)13310.800 砷As800~860公式(2)47.16.692 三氧化二砷As2O3100~310公式(2)111.3512.127 三氧化二砷As2O3315~490公式(2)52.126.513 氩Ar-207.62~-189.19公式(2)7.81457.5741 金Au2315~2500公式(2)3859.853 三氯化硼BCl3……6.18811756.89214.0 钡Ba930~1130公式(2)35015.765 铋Bi1210~1420公式(2)2008.876 溴Br2……6.83298113.0228.0 碳C3880~4430公式(2)5409.596 二氧化碳CO2……9.641771284.07268.432 二硫化碳CS2-10~+1606.851451122.50236.46 一氧化碳CO-210~-1606.24020230.274260.0 四氯化碳CCl4……6.933901242.43230.0 钙Ca500~700公式(2)1959.697 钙960~1100公式(2)37016.240 镉Cd150~320.9公式(2)1098.564 镉500~840公式(2)99.97.897 氯Cl2……6.86773821.107240 二氧化氯ClO2-59~+11公式(2)27.267.893 钴Co2374公式(2)3097.571 铯Cs200~230公式(2)73.46.949 铜Cu2100~2310公式(2)46812.344 氯化亚铜Cu2Cl2878~1369公式(2)80.705.454 铁Fe2220~2450公式(2)3097.482
水的饱和蒸汽压与温度对应表
水的饱和蒸汽压与温度对应表 蒸气压蒸气压指的是在液体(或者固体)的表面存在着该物质的蒸气,这些蒸气对液体表面产生的压强就是该液体的蒸气压。比如,水的表面就有水蒸气压,当水的蒸气压达到水面上的气体总压的时候,水就沸腾。我们通常看到水烧开,就是在100摄氏度时水的蒸气压等于一个大气压。蒸气压随温度变化而变化,温度越高,蒸气压越大,当然还和液体种类有关。一定的温度下,与同种物质的液态(或固态)处于平衡状态的蒸气所产生的压强叫饱和蒸气压,它随温度升高而增加。如:放在杯子里的水,会因不断蒸发变得愈来愈少。如果把纯水放在一个密闭的容器里,并抽走上方的空气。当水不断蒸发时,水面上方气相的压力,即水的蒸气所具有的压力就不断增加。但是,当温度一定时,气相压力最终将稳定在一个固定的数值上,这时的气相压力称为水在该温度下的饱和蒸气压力。当气相压力的数值达到饱和蒸气压力的数值时,液相的水分子仍然不断地气化,气相的水分子也不断地冷凝成液体,只是由于水的气化速度等于水蒸气的冷凝速度,液体量才没有减少,气体量也没有增加,液体和气体达到平衡状态。所以,液态纯物质蒸气所具有的压力为其饱和蒸气压力时,气液两相即达到了相平衡。饱和蒸气压是物质的一个重要性质,它的大小取决于物质的本性和温度。饱和蒸气压越大,表示该物质越容易挥
发。 当气液或气固两相平衡时,气相中A物质的气压,就为液相或固相中A物质的饱和蒸气压,简称蒸气压。下面为影响因素: 1.对于放在真空容器中的液体,由于蒸发,液体分子不断进入气相,使气相压力变大,当两相平衡时气相压强就为该液体饱和蒸汽压,其也等于液相的外压;温度升高,液体分子能量更高,更易脱离液体的束缚进入气相,使饱和蒸气压变大。 2.但是一般液体都暴露在空气中,液相外压=蒸气压力+空气压力=101.325KPa),并假设空气不溶于这种液体,一般情况由于外压的增加,蒸气压变大(不过影响比较小) 3.一般讨论的蒸气压都为大量液体的蒸气压,但是当液体变为很小的液滴是,且液滴尺寸越小,由于表面张力而产生附加压力越大,而使蒸气压变高(这也是形成过热液体,过饱和溶液等亚稳态体系的原因)。所以蒸气压与温度,压力,物质特性,在表面化学中液面的曲率也有影响. 不同物质的蒸气压不同,下面总结给出水在不同温度下的饱和蒸气压:
水的饱和蒸汽压与温度对应表[1]
水的饱和蒸汽压与温度对应表 饱和蒸汽压力所对应的温度 压力/Mpa l/kg温度/℃汽化潜热 kJ/kg 汽化潜热 kca 0.1 99.634 2257.6 539.32 0.12 104.81 2243.9 536.05 0.14 109.318 2231.8 533.16 0.16 113.326 2220.9 530.55 0.18 116.941 2210.9 528.17 0.2 120.24 2201.7 525.97 0.25 127.444 2181.4 521.12 0.3 133.556 2163.7 516.89 0.35 138.891 2147.9 513.12 0.4 143.642 2133.6 509.7 0.5 151.867 2108.2 503.63 0.6 158.863 2086 498.33 0.7 164.983 2066 493.55 0.8 170.444 2047.7 489.18 0.9 175.389 2030.7 485.12 1 179.916 2014.8 481.32 1.1 184.1 1999.9 477.76 1.2 187.995 1985.7 474.37 1.3 191.644 197 2.1 471.12 1.4 195.078 1959.1 468.01 1.5 198.327 1946.6 465.03 1.6 201.41 1934.6 46 2.16 1.7 204.346 1923 459.39 1.8 207.151 1911.7 456.69 1.9 209.838 1900.7 454.06 2 212.417 1890 451.51 2.2 217.289 1869.4 446.58 2.4 221.829 1849.8 441.9 温度℃压力Kg/cm2 温度℃压力Kg/cm2 温度℃压力Kg/cm2 100 1.0332 118↓ 1.8995 136↓ 3.286 101 1.0707 119 1.9612 137 3.382 102 1.1092 120 2.0245 138 3.481 103 1.1489 121 2.0895 139 3.582 104 1.1898 122 2.1561 140 3.685 105 1.2318 123 2.2245 141 3.790 106 1.2751 124 2.2947 142 3.898 107 1.3196 125 2.3666 143 4.009 108 1.3654 126 2.4404 144 4.122 109 1.4125 127 2.5160 145 4.237
饱和蒸汽压计算方法
There is a large number of saturation vapor pressure equations used to calculate the pressure of water vapor over a surface of liquid water or ice. This is a brief overview of the most important equations used. Several useful reviews of the existing vapor pressure curves are listed in the references. Please note the updated discussion of the WMO formulation. 1) Vapor Pressure over liquid water below 0°C ?Goff Gratch equation (Smithsonian Tables, 1984, after Goff and Gratch, 1946): Log10p w = -7.90298 (373.16/T-1) [1] + 5.02808 Log10(373.16/T) - 1.3816 10-7 (1011.344 (1-T/373.16)-1) + 8.1328 10-3 (10-3.49149 (373.16/T-1) -1) + Log10(1013.246) with T in [K] and p w in [hPa] ?WMO (Goff, 1957): Log10p w = 10.79574 (1-273.16/T)[2] - 5.02800 Log10(T/273.16) + 1.50475 10-4 (1 - 10(-8.2969*(T/273.16-1))) + 0.42873 10-3 (10(+4.76955*(1-273.16/T)) - 1) + 0.78614 with T in [K] and p w in [hPa] (Note: WMO based its recommendation on a paper by Goff (1957), which is shown here. The recommendation published by WMO (1988) has several typographical errors and cannot be used. A corrigendum (WMO, 2000) shows the term +0.42873 10-3 (10(-4.76955*(1-273.16/T)) - 1) in the fourth line compared to the original publication by Goff (1957). Note the different sign of the exponent. The earlier 1984 edition shows the correct formula.) ?Hyland and Wexler (Hyland and Wexler, 1983): Log p w = -0.58002206 104 / T [3] + 0.13914993 101
蒸气压和相对湿度的计算公式
水蒸气压和相对湿度的计算公式 要求水蒸气压和相对湿度时,虽然最好用通风乾湿计,但也可采用不通风乾湿计。由乾湿计计算水 蒸气压和相对湿度的公式为: 1. 从通风乾湿计的度数计算水蒸气压: (1)湿球不结冰时 e =E’w–0.5(t-t’)P/755 (2)湿球结冰时 e =E’i –0.44(t-t’)P/755 式中, t:乾球读数(oC) t’:湿球读数(oC) E’w:t’(oC)的水饱和蒸气压 E’i:t’(oC)的冰饱和蒸气压 e:所求水蒸气压 P:大气压力 2. 从不通风乾湿计的度数计算水蒸气压: (1)湿球不结冰时 e=E’ w-0.0008P(t-t’) (2)湿球结冰时 e=E’ i-0.0007P(t-t’) 此处所用符号的意义同上。压力单位都统一用mmHg或mb。 3.求相对湿度: H=e/Ew×100 式中H为所求相对湿度(%),Ew为t(oC)的饱和蒸气压(即使在0oC以下时也不使用Ei)。
水的蒸气压 水和所有其它液体一样,其分子在不断运动着,其中有少数分子因为动能较大,足以冲破表面张力的影响而进入空间,成为蒸气分子,这种现象称为蒸发。液面上的蒸气分子也可能被液面分子吸引或受外界压力抵抗而回入液体中,这种现象称为凝聚。如将液体置于密闭容器内,起初,当空间没有蒸气分子时,蒸发速率比较大,随着液面上蒸气分子逐渐增多,凝聚的速率也随之加快。这样蒸发和凝聚的速率逐渐趋于相等,即在单位时间内,液体变为蒸气的分子数和蒸气变为液体的分子数相等,这时即达到平衡状态,蒸发和凝聚这一对矛盾达到暂时的相对统一。当达到平衡时,蒸发和凝聚这两个过程仍在进行,只是两个相反过程进行的速率相等而已。平衡应理解为运态的平衡,绝不意味着物质运动的停止。 与液态平衡的蒸气称为饱和蒸气。饱和蒸气所产生的压力称为饱和蒸气压。每种液体在一定温度下,其饱和蒸气压是一个常数,温度升高饱和蒸气压也增大。水的饱和蒸气压和温度的关系列于表中。 表水的蒸气压和温度的关系
饱和蒸气压-水-压力温度密度表
水蒸气是一种离液态较近的气体,在空气处理中应用广泛,易获得污染小。以实践经验总结出的数据图表作为计算依据 饱和水蒸气压力温度密度表 温度 (t) 压力 (P) 密度(ρ)温度 (t) 压力(P) 密度(ρ) ℃ MPa kg/m3 ℃ MPa kg/m3 100 0.1013 0.5977 128 0.2543 1.415 101 0.1050 0.6180 129 0.2621 1.455 102 0.1088 0.6388 130 0.2701 1.497 103 0.1127 0.6601 131 0.2783 1.539 104 0.1167 0.6821 132 0.2867 1.583 105 0.1208 0.7046 133 0.2953 1.627 106 0.1250 0.7277 134 0.3041 1.672 107 0.1294 0.7515 135 0.3130 1.719 108 0.1339 0.7758 136 0.3222 1.766 109 0.1385 0.8008 137 0.3317 1.815 110 0.1433 0.8265 138 0.3414 1.864 111 0.1481 0.8528 139 0.3513 1.915 112 0.1532 0.8798 140 0.3614 1.967 113 0.1583 0.9075 141 0.3718 2.019 114 0.1636 0.9359 142
115 0.1691 0.9650 143 0.3931 2.129 116 0.1746 0.9948 144 0.4042 2.185 117 0.1804 1.025 145 0.4155 2.242 118 0.1863 1.057 146 0.4271 2.301 119 0.1923 1.089 147 0.4389 2.361 120 0.1985 1.122 148 0.4510 2.422 121 0.2049 1.155 149 0.4633 2.484 122 0.2114 1.190 150 0.4760 2.548 123 0.2182 1.225 151 0.4888 2.613 124 0.2250 1.261 152 0.5021 2.679 125 0.2321 1.298 153 0.5155 2.747 126 0.2393 1.336 154 0.5292 2.816 127 0.2467 1.375 155 0.5433 2.886 温度 (t) 压力 (P) 密度(ρ)温度 (t) 压力(P) 密度(ρ) ℃ MPa kg/m3 ℃ MPa kg/m3 156 0.5577 2.958 184 1.0983 5.629 157 0.5723 3.032 185 1.1233 5.752 158 0.5872 3.106 186 1.1487 5.877 159 0.6025 3.182 187
各种物质饱和蒸汽压的算法
在表 1 中给出了采用Antoine 公式计算不同物质在不同温度下蒸气压 的常数A、B、C。其公式如下 lgP=A-B/(t+C)(1) 式中:P—物质的蒸气压,毫米汞柱; t —温度,℃ 公式(1)适用于大多数化合物;而对于另外一些只需常数B与C值的物质,则可采用 (2)公式进行计算 lgP=T+C (2) 式中:P—物质的蒸气压,毫米汞柱; 表 1 不同物质的蒸气压 名称分子式范围(℃) A B C 1,1,2- 三氯乙烷C2H3Cl3 1,1,2 一三氯乙烯C2HCl3 1,2 一丁二烯C4H6 -60 ~+80 1,3 一丁二烯C4H6 -80 ~+65 2- 甲基丙烯-1 C4H8 2- 甲基丁二烯-1,3 C5H8 -50 ~+95 α - 甲基綦C11H10 α - 萘酚C10H8O β- 甲基萘C11H10 β - 萘酚C10H8O 氨NH3 -83 ~+60 氨基甲酸乙酯C3H7O2N 钡Ba 930~1130 公式(2) 苯C6H6 苯胺C6H7N 苯酚C6H6O 苯甲醇C7H8O 20~113
苯甲醇 C7H8O 113~300 苯甲醚 C7H8O 苯甲酸C7H6O2 60~110 公式(2) 苯甲酸甲酯 C8H8O2 25~100 苯甲酸甲酯 C8H8O2 100~260 苯乙烯 C8H8 铋Bi 1210~1420 公式(2) 蓖C14H10 100~160 公式(2) 蓖 C14H10 223~342 公式(2) 蓖醌C14H3O2 224~286 公式(2) 蓖醌C14H3O2 285~370 公式(2) 丙酸C3H6O2 0~60 丙酸C3H6O2 60~185 丙酮C3H6O 丙烷C3H8 丙烯C3H6 丙烯腈C3H3N -20 ~+140 铂Pt 1425~1765 公式(2) 草酸C2H2O4 55~105 公式(2) 臭氧O3 醋酸甲酯C3H6O2 氮N2 -210 ~-180 碲化氢H2Te -46 ~0 公式(2) 碘I2 碘化钾KI 843~1028 公式(2) 碘化钾KI 1063~1333 公式(2) 碘化钠NaI 1063~1307 公式(2) 碘化氢HI -97 ~-51 公式(2) 碘化氢HI -50 ~-34 公式(2)
水的饱和蒸汽压与温度对应表
水的饱和蒸汽压与温度对应表 温度℃压力Kg/cm2 温度℃压力Kg/cm2 温度℃压力Kg/cm2 100 1.0332 118↓ 1.8995 136↓ 3.286 101 1.0707 119 1.9612 137 3.382 102 1.1092 120 2.0245 138 3.481 103 1.1489 121 2.0895 139 3.582 104 1.1898 122 2.1561 140 3.685 105 1.2318 123 2.2245 141 3.790 106 1.2751 124 2.2947 142 3.898 107 1.3196 125 2.3666 143 4.009 108 1.3654 126 2.4404 144 4.122 109 1.4125 127 2.5160 145 4.237 110 1.4609 128 2.5935 146 4.355 111 1.5106 129 2.6730 147 4.476 112 1.5618 130 2.7544 148 4.599 113 1.6144 131 2.8378 149 4.725 114 1.6684 132 2.9233 150 4.854 115 1.7239 133 3.011 151 4.985 116 1.7809 134 3.101 152 5.120 117↑ 1.8394 135 3.192 153 5.257 154↓ 5.397 176↓ 9.317 198↓ 15.204 155 5.540 177 9.538 199 15.528 156 5.686 178 9.763 200 15.857 157 5.836 179 9.992 201 16.192 158 5.989 180 10.225 202 16.532 159 6.144 181 10.462 203 16.877 160 6.302 182 10.703 204 17.228 161 6.464 183 10.950 205 17.585 162 6.630 184 11.201 206 17.948 163 6.798 185 11.456 207 18.316 164 6.970 186 11.715 208 18.690 165 7.146 187 11.979 209 19.070 166 7.325 188 12.248 210 19.456 167 7.507 189 12.522 211 19.848 168 7.693 190 12.800 212 20.246 169 7.883 191 13.083 213 20.651 170 8.076 192 13.371 214 21.061 171 8.274 193 13.644 215 21.477 172 8.475 194 13.962 216 21.901 173 8.679 195 14.265 217 22.331 174 8.888 196 14.573 218 22.767
饱和蒸气压计算方法
饱和蒸气压 编辑[bǎo hé zhēng qì yā] 在密闭条件中,在一定温度下,与固体或液体处于相平衡的蒸气所具有的压力称为饱和蒸气 压。同一物质在不同温度下有不同的蒸气压,并随着温度的升高而增大。不同液体饱和蒸气 压不同,溶剂的饱和蒸气压大于溶液的饱和蒸气压;对于同一物质,固态的饱和蒸气压小于 液态的饱和蒸气压。 目录 1定义 2计算公式 3附录 ?计算参数 ?水在不同温度下的饱和蒸气压 1定义编辑 饱和蒸气压(saturated vapor pressure) 例如,在30℃时,水的饱和蒸气压为4132.982Pa,乙醇为10532.438Pa。而在100℃时,水 的饱和蒸气压增大到101324.72Pa,乙醇为222647.74Pa。饱和蒸气压是液体的一项重要物理 性质,液体的沸点、液体混合物的相对挥发度等都与之有关。 2计算公式编辑 (1)Clausius-Claperon方程:d lnp/d(1/T)=-H(v)/(R*Z(v)) 式中p为蒸气压;H(v)为蒸发潜热;Z(v)为饱和蒸汽压缩因子与饱和液体压缩因子之差。 该方程是一个十分重要的方程,大部分蒸汽压方程是从此式积分得出的。 (2)Clapeyron 方程: 若上式中H(v)/(R*Z(v))为与温度无关的常数,积分式,并令积分常数为A,则得Clapeyron 方程:ln p=A-B/T 式中B=H(v)/(R*Z(v))。 (3)Antoine方程:lg p=A-B/(T+C) 式中,A,B,C为Antoine常数,可查数据表。Antoine方程是对Clausius-Clapeyron方程 最简单的改进,在1.333~199.98kPa范围内误差小。 3附录编辑 计算参数 在表1中给出了采用Antoine公式计算不同物质在不同温度下蒸气压的常数A、B、C。其公 式如下 lgP=A-B/(t+C) (1) 式中:P—物质的蒸气压,毫米汞柱; t—温度,℃ 公式(1)适用于大多数化合物;而对于另外一些只需常数B与C值的物质,则可采用(2) 公式进行计算 lgP=-52.23B/T+C (2) 式中:P—物质的蒸气压,毫米汞柱; 表1 不同物质的蒸气压 名称分子式范围(℃)A B C 1,1,2-三氯乙烷C2H3Cl3\ 6.851891262.570205.170 1,1,2一三氯乙烯C2HCl3\7.028081315.040230.000 1,2一丁二烯C4H6-60~+807.161901121.000251.000
饱和蒸汽压
饱和蒸汽压
饱和蒸气压 编辑 [b ǎo h ézh ēng q ìy ā] 饱和蒸汽压即饱和蒸气压。 在密闭条件中,在一定温度下,与固体或液体处于相平衡的蒸气所具有的压力称为饱和蒸气压。同一物质在不同温度下有不同的蒸气压,并随着温度的升高而增大。不同液体饱和蒸气压不同,溶剂的饱和蒸气压大于溶液的饱和蒸气压;对于同一物质,固态的饱和蒸气压小于液态的饱和蒸气压。 蒸汽压指的是在液体(或者固体)的表面存在着该物质的蒸汽,这些蒸汽对液体表面产生的压强就是该液体的蒸汽压。比如,水的表面就有水蒸汽压,当水的蒸汽压达到水面上的气体总压的时候,水就沸腾。我们通常看到水烧开,就是在100 摄氏度时水的蒸汽压等于一个大气压。蒸汽压随温度变化而变化,温度越高,蒸汽压越大,当然还和液体种类有关。一定的温度下,与同种物质的液态(或固态) 处于平衡状态的蒸汽所产生的压 强叫饱和蒸汽压,它随温度升高而增加。如:放在杯子里的水,会因不断蒸发变得愈来愈少。如果把纯水放在一个密闭的容器里,并抽走上方的空气。当水不断蒸发时,水面上方汽相的压力,即水的蒸汽所具有的压力就不断增加。但是,当温度一定时,汽相压力最终将稳定在一个固定的数值上,这时的汽相压力称为水在该温度下的饱和蒸汽压力。当汽相压力的数值达到饱和蒸汽压力的数值时,液相的水分子仍然不断地气化,汽相的水分子也不断地冷凝成液体,只是由于水的气化速度等于水蒸汽的冷凝速度,液体量才没有减少,气体量也没有增加,液体和气体达到平衡状态。所以,液态纯物质蒸汽所具有的压力为其饱和蒸汽压力时,汽液两相即达到了相平衡。饱和蒸汽压是物质的一个重要性质,它的大小取决于物质的本性和温度。饱和蒸汽压越大,表示该物质越容易挥发。 1 定义编辑 饱和蒸气压( saturated vapor pressure ) 例如,在30℃时,水的饱和蒸气压为4132.982Pa, 乙醇为10532.438Pa 。而在100 ℃时,水的饱和蒸气压增大到101324.72Pa, 乙醇为222647.74Pa 。饱和蒸气压是液体的一项重要物理性质,液体的沸点、液体混合物的相对挥发度等都与之有关。 2 计算公式编辑 (1) Clausius-Claperon 方程:d lnp/d(1/T)=-H(v)/(R*Z(v)) 式中p 为蒸气压;H(v) 为蒸发潜热;Z(v) 为饱和蒸汽压缩因子与饱和液体压缩因子之差。该方程是一个十分重要的方程,大部分蒸汽压方程是从此式积分得出的。 (2) Clapeyron 方程: 若上式中H(v)/(R*Z(v)) 为与温度无关的常数,积分式,并令积分常数为A,则得Clapeyron 方程:ln p=A-B/T 式中B=H(v)/(R*Z(v)) 。 (3) Antoine 方程:lg p=A-B/(T+C) 式中,A,B,C 为Antoine 常数,可查数据表。Antoine 方程是对Clausius-Clapeyron 方程最简单的改进,在 1.333~199.98kPa 范围内误差小。 3 附录编辑 计算参数 在表 1 中给出了采用Antoine 公式计算不同物质在不同温度下蒸气压的常数A、 B 、C 。其公式如下 lgP=A-B/(t+C) ( 1) 式中:P —物质的蒸气压,毫米汞柱; t—温度,℃ 公式( 1)适用于大多数化合物;而对于另外一些只需常数 B 与 C 值的物质,则可采用( 2)公式进行计算 lgP=-52.23B/T+C ( 2 )
液体饱和蒸汽压与温度关系
液体饱和蒸汽压与温度关系 一、实验目的 1.学习动态法测定液体饱和蒸汽压与温度的关系。 2.使用克劳修斯-克拉佩龙关系式计算水的气化热。 3、掌握气压计、U型管压差计夫人使用的方法和蒸空泵的使用。 4、学习excel处理实验数据。 二、实验原理 在一定温度下与液体处于平衡状态时蒸气的压力称为该温度下的饱和蒸汽压。液体的蒸汽压是随着温度的改变而改变的,当温度升高时有更多的高动能的分子能够由液面逸出,因而蒸汽压增大。当蒸汽压与外界压力相等时,液体就沸腾。外压不同时液体的沸点也就不同,把1大气压时的沸腾温度定义为液体的正常沸点。 液体的饱和蒸汽压与温度的关系可用户克劳修斯-克拉佩龙方程式表示: dInp/dT=—ΔH 汽/RT2 在温度较小的变化范围内,H 汽可视为常数,对上式积分得: Inp=—ΔH 汽/RT+B 测定液体饱和蒸汽压的方法主要有: 饱和气流法、静态法、动态法。
本实验用动态法,利用当液体的蒸汽压与外压相等时液体沸腾的原理,测定液体在不同外压时的沸点就可求出不同温度下的蒸汽压。优点是对温度的控制要求不高,对于沸点低于100℃的液体,如四氯化碳、丙酮、氯仿等也可达到一定的精确度。饱和气流法不仅可测液体 三、仪器与试剂 1.仪器: 三颈烧瓶1个冷凝管1只水银温度计1只电热套(300-500W)1个真空泵及附件1套 2.试剂: 蒸馏水 四、主要实验步骤 1、准确读取实验时的大气压,实验结束的时候在读一次,取平均值。 2、先用洗液清洗三颈瓶,再用自来水冲洗,最后用蒸馏水洗两次。瓶内加约的蒸馏水,加入少许沸石。测温的温度计用纱布包裹,部分浸入水中。用橡皮筋将测环境温度的温度计绑在一起,但要能移动,作露茎校正。 3、系统检漏: 启动真空泵,系统减压53-63Kpa后,关闭真空泵,5分钟后系统压力不在发生变化,则属于正常。否则,检查各连接处是否漏气,可用少许真空酯涂在该处。 4、测定水在不同外压下沸腾的温度: 启动真空泵,让体系压力低于环境压力40-53KPa左右。加热,让水平稳的沸腾,调整测露茎的温度计水银球于测体系温度的温度计汞柱露出部分的中部。隔2-3分钟读数,两次读数基本没有变化时,记录t 观和t 环,同时记录压差计的读数。
饱和蒸汽压与温度计算关系.汇总
饱和蒸汽压与温度计算关系.汇总
————————————————————————————————作者:————————————————————————————————日期: 2
在表1中给出了采用Antoine公式计算不同物质在不同温度下蒸气压的常数A、B、C。其公式如lgP=A-B/(t+C) (1)式中:P—物质的蒸气压,毫米汞柱;1mm汞柱=133.3Pa,一个标准大气压约760mm汞柱t—温度,℃。公式(1)适用于大多数化合物;而对于另外一些只需常数B与C值的物质,则可采用(2)公式进行计算 lgP=-52.23B/T+C (2)式中:P—物质的蒸气压,毫米汞柱;这是所有单位的换算:1兆帕(MPa)=145磅/英寸 2(psi)=10.2千克/厘米2(kg/cm2)=10巴(bar)=9.8大气压(atm) 1磅/英寸2(psi)=0.006895兆帕(MPa)=0.0703千克/厘米2(kg/cm2)=0.0689巴(bar)=0.068大气压(atm) 1巴(bar)=0.1兆帕(MPa)=14.503磅/英寸2(psi)=1.0197千克/厘米2(kg/cm2)=0.987大气压(atm) 1大气压(atm)=0.101325兆帕(MPa)=14.696磅/英寸2(psi)=1.0333千克/厘米2(kg/cm2)=1.0133巴(bar) 名称分子式范围(℃) A B C T温度℃ 银Ag 1650~1950 公式(2)250 8.76 氯化银AgCl 1255~1442 公式(2)185.5 8.179 三氯化铝AlCl3 70~190 公式(2)115 16.24 氧化铝Al2O3 1840~2200 公式(2)540 14.22 砷As 440~815 公式(2)133 10.800
湿度 露点 饱和水蒸气压 计算公式
饱和水蒸气压公式 饱和是一种动态平衡态,在该状态下,气相中的水汽浓度或密度保持恒定。在整个湿度的换算过程中,对于饱和水蒸气压公式的选取显得尤为重要,因此下面介绍几种常用的。 (1)、克拉柏龙-克劳修斯方程 该方程是以理论概念为基础的,表示物质相平衡的关系式,它把饱和蒸汽压随温度的变化、容积的变化和过程的热效应三者联系起来。方程如下: T-为循环的温度;dT-为循环的温差;L-为热量,这里为汽化潜热(相变热);ν-为饱和蒸汽的比容;ν^-为液体的比容;e-为饱和蒸汽压。 这就是著名的克拉柏龙-克劳修斯方程。该方程不但适用于水的汽化,也适用于冰的升华。当用于升华时,L为升华潜热。 (2)、卡末林-昂尼斯方程 实际的蒸汽和理想气体不同,原因在于气体分子本身具有体积,分子间存在吸引力。卡末林 - 昂尼斯气体状态方程考虑了这种力的影响。卡末林-昂尼斯于1901年提出了状态方程的维里表达式(e表示水汽压)。 这些维里系数都可以通过实验测定,其中的第二和第三维里系数都已经有了普遍的计算公式。例如接近大气压力,温度在150K到400K时,第二维里系数计算公式: 一般在我们所讨论的温度范围内,第四维里系数可以不予考虑。 (3)、Goff-Grattch 饱和水汽压公式 从1947年起,世界气象组织就推荐使用 Goff-Grattch 的水汽压方程。该方程是以后多年世界公认的最准确的公式。它包括两个公式,一个用于液 - 汽平衡,另一个用于固 - 汽平衡。 对于水平面上的饱和水汽压 式中,T0为水三项点温度 273.16 K 对于冰面上的饱和水汽压 以上两式为 1966 年世界气象组织发布的国际气象用表所采用。 (4)、Wexler-Greenspan 水汽压公式 1971年,美国国家标准局的 Wexler 和 Greenspan 根据 25 ~ 100 ℃范围水面上饱和水汽压的精确测量数据,以克拉柏龙一克劳修斯方程为基础,结合卡末林 - 昂尼斯方程,经过简单的数学运算并参照试验数据作了部分修正,导出了 0 ~ 100 ℃范围内水面上的饱和水汽压的计算公式,该式的计算值与实验值基本符合。
常见物质的安托尼常数-计算饱和蒸汽压
http: 一些常见物质的Antoine(安托万)常数(修正) 2007-11-09 09:22 不同物质的蒸气压(摘自http: 在表10中给出了采用Antoine公式计算不同物质在不同温度下蒸气压的常数 A、B、C。其公式如下 lgP=A-B/(t+C)(7-10) 式中: P—物质的蒸气压,毫米汞柱; t—温度,℃ 公式(7—10)适用于大多数化合物;而对于另外一些只需常数B与C值的物质,则可采用(7—11)公式进行计算 lgP=-52.23B/T+C (7-11) 式中: P—物质的蒸气压,毫米汞柱; T—绝对温度,(t℃+273.1). 表10不同物质的蒸气压 名称分子式范围(℃) A B C 银Ag 1650~1950公式(7-11)250 8.76 氯化银AgCl 1255~1442公式(7-11)185.5 8.179
三氯化铝AlCl3 70~190公式(7-11)115 16.24 氧化铝Al2O3 1840~2200公式(7-11)540 14.22 砷As 440~815公式(7-11)133 10.800 砷As 800~860公式(7-11)47.1 6.692 三氧化二砷As2O3 100~310公式(7-11)111.35 12.127三氧化二砷As2O3 315~490公式(7-11)52.12 6.513 氩Ar -207.62~-189.19公式(7-11)7.8145 7.5741 金Au 2315~2500公式(7-11)385 9.853 三氯化硼BCl3……6.18811 756.89 214.0 钡Ba 930~1130公式(7-11)350 15.765 铋Bi 1210~1420公式(7-11)200 8.876 溴Br2……6.83298 113.0 228.0 碳C 3880~4430公式(7-11)540 9.596 二氧化碳CO2……9.64177 1284.07 268.432 二硫化碳CS2 -10~+160 6.85145 1122.50 236.46 一氧化碳CO -210~-160 6.24020 230.274 260.0 四氯化碳CCl4……6.93390 1242.43 230.0 钙Ca 500~700公式(7-11)195 9.697 钙960~1100公式(7-11)370 16.240 镉Cd 150~320.9公式(7-11)109 8.564 镉500~840公式(7-11)99.9 7.897
相关文档
- 水的饱和蒸汽压与温度对应表
- 丙烯温度对应饱和蒸气压及密度一览表
- 饱和蒸汽压与温度的关系
- 水的饱和蒸汽压和温度对应表资料讲解
- 饱和蒸汽压力与温度对照表
- 水的饱和蒸汽压和温度对应表
- 饱和蒸汽压与温度的关系
- 饱和蒸汽压力与温度对照表
- 水的饱和蒸汽压与温度对应表
- 水在不同温度下的饱和蒸汽压
- 饱和蒸汽压与蒸汽温度关系
- 不同温度下空气中饱和水分含量及饱和蒸汽压
- 水的饱和蒸汽压与温度对应表
- 饱和蒸汽压与温度计算关系
- 温度与饱和蒸汽压对照表
- 烃类饱和蒸汽压与温度对照表 汇总
- 饱和蒸气气压和温度的关系
- 水的饱和蒸汽压与温度的关系(1)
- 丙烯温度对应饱和蒸气压及密度一览表
- 不同温度下空气中饱和水分含量及饱和蒸汽压..
